7.1
Dari Fisika Klasik ke Teori Quantum
Upaya awal oleh fisikawan
abad kesembilan belas untuk memahami atom dan molekul hanya berhasil dengan
terbatas. Dengan mengasumsikan bahwa molekul berperilaku seperti bola pantulan,
fisikawan dapat memprediksi dan menjelaskan beberapa fenomena makroskopis,
seperti tekanan yang diberikan oleh gas. Namun, model ini tidak menjelaskan
stabilitas molekul; artinya, itu tidak bisa menjelaskan kekuatan yang
menyatukan atom. Era baru dalam fisika dimulai pada 1900 dengan seorang
fisikawan muda Jerman bernama Max Planck.
Untuk memahami teori kuantum
planck, kita harus memahami tentang sifat gelombang, gelombang sendiri
dicirikan oleh panjang dan tingginya dan oleh jumlah gelombang yang melewati
titk tertentu dalam satu detik.
Radiasi Elektromagnetik Ada banyak jenis
gelombang, seperti gelombang air, gelombang suara, dan gelombang cahaya. Pada
tahun 1873 James Clerk Maxwell mengusulkan bahwa cahaya tampak terdiri dari
gelombang elektromagnetik. Menurut teori Maxwell, gelombang elektromagnetik memiliki
komponen medan listrik dan komponen medan magnet.
Radiasi elektromagnetik adalah emisi dan transmisi energi dalam bentuk gelombang
elektromagnetik.
Teori Kuantum Planck
Planck mengatakan bahwa atom dan molekul dapat memancarkan (atau menyerap) energi hanya dalam jumlah diskrit, seperti paket kecil atau bundel. Planck memberi nama kuantum ke jumlah energi terkecil yang dapat dipancarkan (atau diserap) bentuk radiasi elektromagnetik. Energi E dari satu kuantum energi diberikan oleh
di mana h disebut konstanta Planck dan n adalah frekuensi radiasi. Dengan nilai konstan
6,626070150(81)×10−34
J s
|
7.2 Efek Fotoelektrik
Pada tahun 1905, berjarak lima tahun setelah planck mengeluarkan teori kuantum, Albert Einstein
menggunakan teori tersebut untuk memecahkan misteri lain dalam fisika, efek fotolistrik, sebuah
fenomena di mana elektron dikeluarkan dari permukaan logam tertentu yang terkena cahaya setidaknya
frekuensi minimum tertentu, yang disebut frekuensi ambang batas. Efek fotolistrik tidak dapat dijelaskan
oleh teori gelombang cahaya, walaupun jumlah electron yang dikeluarkan proporsional dengan intensitas cahaya.
Einstein menyimpulkan bahwa setiap foton harus memiliki energi E, yang diberikan oleh persamaan
Jika frekuensi foton sedemikian rupa sehingga h n persis sama dengan energi yang mengikat
elektron dalam logam, maka cahaya akan memiliki energi yang cukup untuk menjatuhkan elektron. Jika
kita menggunakan cahaya dengan frekuensi yang lebih tinggi, maka elektron tidak hanya akan terurai,
tetapi mereka juga akan memperoleh energi kinetik. Situasi ini dirangkum oleh persamaan
Di mana KE adalah energi kinetik dari elektron yang dikeluarkan dan W adalah fungsi kerja,
yang merupakan ukuran seberapa kuat elektron dipegang dalam logam. Dengan persamaan lain
menunjukkan bahwa semakin energik foton (yaitu, semakin tinggi frekuensinya), semakin besar
energi kinetik dari elektron yang dikeluarkan.
7.3 Teori Bohr tentang Hidrogen Atom
Spektrum Emisi
Sejak abad ketujuh belas, ketika Newton menunjukkan bahwa sinar matahari terdiri dari
berbagai komponen warna yang dapat digabungkan kembali untuk menghasilkan cahaya putih,
ahli kimia dan fisikawan telah mempelajari karakteristik spektrum emisi, yaitu, spektrum garis
kontinu atau garis radiasi yang dipancarkan oleh zat-zat. Ciri umum dari spektrum emisi matahari
dan padatan yang dipanaskan adalah keduanya kontinu; yaitu, semua panjang gelombang cahaya
tampak diwakili dalam spektrum (lihat wilayah yang terlihat pada Gambar 7.4). Spektrum emisi
atom dalam fase gas, di sisi lain, tidak menunjukkan penyebaran panjang gelombang dari merah
ke ungu; melainkan, atom-atom menghasilkan garis-garis terang di berbagai bagian spektrum yang terlihat.
Spektrum Emisi Atom Hidrogen Pada tahun 1913, tidak lama setelah penemuan Planck dan Einstein,
penjelasan teoretis tentang spektrum emisi atom hidrogen disajikan oleh fisikawan Denmark Niels Bohr.
Bohr menunjukkan bahwa energi yang dapat dihuni oleh sebuah elektron dalam atom hidrogen diberikan oleh
di mana RH, konstanta Rydberg untuk atom hidrogen, memiliki nilai 2.18 x 1018 J.
Teori Bohr memungkinkan kita untuk menjelaskan spektrum garis atom hidrogen.
Energi radiasi yang diserap oleh atom menyebabkan elektron bergerak dari keadaan berenergi
lebih rendah (ditandai dengan nilai n yang lebih kecil) ke keadaan berenergi lebih tinggi
(ditandai dengan nilai n yang lebih besar).
KIMIA DALAM AKSI
7.4 Sifat Ganda Elektron
Pisikis keduanya bingung dan penasaran dengan teori Bohr. Mereka mempertanyakan
mengapa energi elektron hidrogen terkuantisasi. Selama satu dekade, tidak seorang pun, termasuk
Bohr sendiri, yang memiliki penjelasan logis. Pada tahun 1924 Louis de Broglie memberikan
solusi untuk teka-teki ini. De Broglie beralasan bahwa jika gelombang cahaya dapat berperilaku
seperti aliran partikel (foton), maka mungkin partikel seperti elektron dapat memiliki sifat gelombang.
Menurut de Broglie, elektron yang terikat pada nukleus berperilaku seperti gelombang yang berdiri.
De Broglie berpendapat bahwa jika sebuah elektron berperilaku seperti gelombang yang berdiri
dalam atom hidrogen, panjang gelombang harus sesuai dengan keliling orbit.
7.5 Mekanika Kuantum
Untuk menggambarkan masalah mencoba menemukan partikel subatom yang berperilaku seperti
gelombang, Werner Heisenberg merumuskan apa yang sekarang dikenal sebagai prinsip ketidakpastian
Heisenberg: tidak mungkin untuk mengetahui secara bersamaan baik momentum p (didefinisikan
sebagai kecepatan massa kali) maupun posisi partikel dengan pasti. Dinyatakan secara matematis,
Di mana Dx dan Dp adalah ketidakpastian dalam mengukur posisi dan momentum
partikel, masing-masing. Membuat pengukuran momentum suatu partikel lebih tepat
(yaitu, membuat Dp dalam jumlah kecil) berarti bahwa posisi tersebut harus menjadi
kurang tepat (yaitu, Dx akan menjadi lebih besar). Begitu pula jika posisi partikelnya diketahui.
Deskripsi Mekanika Kuantum dari Atom Hidrogen
Persamaan Schrödinger menentukan keadaan energi yang mungkin dimiliki
elektron dalam atom hidrogen dan mengidentifikasi fungsi gelombang yang sesuai (c).
Keadaan energi dan fungsi gelombang ini ditandai oleh sejumlah bilangan kuantum (yang akan
dibahas segera), yang dengannya kita dapat membuat model atom hidrogen yang komprehensif.
Meskipun mekanika kuantum memberi tahu kita bahwa kita tidak dapat menunjukkan dengan
tepat elektron dalam atom, ia menentukan wilayah di mana elektron berada pada waktu tertentu.
1. hardware [kembali]








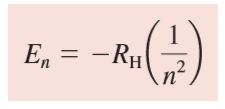



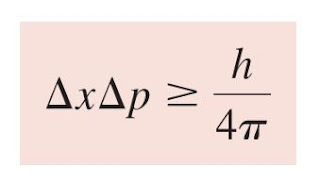
Tidak ada komentar:
Posting Komentar